UNIDAD IV
Alquenos y Alquinos
Los alquenos se
diferencian con los alcanos en que presentan una doble ligadura a lo largo de
la molécula. Esta condición los coloca dentro de los llamados hidrocarburos
insaturados junto con los alquinos. Con respecto a su nomenclatura es como la
de los alcanos salvo la terminación. En lugar de ano como los alcanos es eno.
Al tener una doble ligadura hay dos átomos menos de hidrógeno como veremos en
las siguientes estructuras. Por lo tanto, la fórmula general es CnH2n.
Explicaremos a continuación
como se forma la doble ligadura entre carbonos.
Anteriormente explicamos la
hibridación SP3. Esta
vez se produce la hibridación Sp2.
El orbital 2s se combina con 2 orbitales p, formando en total 3 orbitales
híbridos llamados Sp2.
El restante orbital p queda sin combinar. Los 3 orbitales Sp2 se ubican en el
mismo plano con un ángulo de 120° de distancia entre ellos.
El orbital p
que no participo en la hibridación ocupa un lugar perpendicular al plano que
sostiene a los tres orbitales Sp2.
El enlace doble se forma de
la siguiente manera:
Uno de los orbitales sp2 de un C se enlaza con otro orbital
sp2 del otro C formando un
enlace llamado sigma. El otro enlace está constituido por la superposición de
los enlaces p que no participaron en la hibridación. Esta unión se denomina Pi
(∏).
Así tenemos por ejemplo
Eteno, Propeno, Buteno, etc.
Al nombrar Alquenos y
Alquinos a la doble o triple ligadura se le adjudica un número que corresponde
a la ubicación de dicha ligadura.
Eteno:
CH2 = CH2
Propeno:
CH2 = CH2 –CH3
Buteno – 1
CH2 = CH — CH2 — CH3
Buteno – 2
CH3 — CH = CH — CH3
Pentino – 2
CH3 — C ≡ C —
CH2 —-CH3
Propiedades
Físicas:
Son similares a los
alcanos. Los tres primeros miembros son gases, del carbono 4 al carbono 18
líquidos y los demás son sólidos.
Son solubles en solventes
orgánicos como el alcohol y el éter. Son levemente más densos que los alcanos
correspondientes de igual número de carbonos. Los puntos de fusión y ebullición
son más bajos que los alcanos correspondientes. Es interesante mencionar que la
distancia entre los átomos de carbonos vecinos en la doble ligadura es más
pequeña que entre carbonos vecinos en alcanos. Aquí es de unos 1.34 amstrong y
en los alcanos es de 1.50 amstrong.
Propiedades
Químicas:
Los alquenos son
mucho más reactivos que los Alcanos. Esto se debe a la presencia de la doble
ligadura que permite las reacciones de adición. Las reacciones de adición son
las que se presentan cuando se rompe la doble ligadura, este evento permite que
se adicionen átomos de otras sustancias.
Adición de
Hidrógeno:→
En presencia de
catalizadores metálicos como níquel, los alquenos reaccionan con el hidrógeno,
y originan alcanos.
CH2 = CH2 +
H2 ——> CH3 —
CH3 + 31,6 Kcal
Adición de Halógenos
CH2 =
CH2 + Br2
——-> CH2Br — CH2Br
Dibromo 1-2 Etano
Adición de Hidrácidos:
CH2 = CH2
+ HBr ——-> CH3 —
CH2 Br
Monobromo Etano
Cuando estamos en presencia
de un alqueno de más de 3 átomos de carbono se aplica la regla de Markownicov
para predecir cuál de los dos isómeros tendrá presencia mayoritaria.
H2C = CH — CH3 + H Cl → H3C — CHBr —
CH3 monobromo 2 – propano
→ H3C — CH2 —
CH2Br monobromo 1 – propano
Al adicionarse el hidrácido
sobre el alqueno, se formara casi totalmente el isómero que resulta de unirse
el halógeno al carbono más deficiente en hidrógeno. En este caso se formara más
cantidad de monobromo 2 – propano.
Combustión:
Los alquenos también
presentan la reacción de combustión, oxidándose con suficiente oxigeno.
C2H4
+ 3 O2 —-> 2 CO2
+ 2 H2O
Etano
Diolefinas:
Algunos Alquenos poseen en
su estructura dos enlaces dobles en lugar de uno. Estos compuestos reciben el
nombre de Diolefinas o Dienos. Se nombran como los Alcanos, pero cambiando le
terminación ano por dieno.
H2C = C = CH2
Propadieno – 1,3
H2C = CH — CH = CH2
Butdieno – 1,3
ALQUINOS:
Estos presentan una triple
ligadura entre dos carbonos vecinos. Con respecto a la nomenclatura la
terminación ano o eno se cambia por ino. Aquí hay dos hidrógenos menos que en
los alquenos. Su fórmula general es CnH2n-2.
La distancia entre carbonos vecinos con triple ligadura es de unos 1.20
amstrong.
Para la formación de un
enlace triple, debemos considerar el otro tipo de hibridación que sufre el
átomo de C. La hibridación “sp”.
En esta hibridación, el
orbital 2s se hibridiza con un orbital p para formar dos nuevos orbitales
híbridos llamados “sp”. Por otra parte quedaran 2 orbitales p sin cambios por
cada átomo de C.
El triple enlace que se
genera en los alquinos está conformado por dos tipos de uniones. Por un lado
dos orbitales sp solapados constituyendo una unión sigma. Y las otras dos se
forman por la superposición de los dos orbitales p de cada C. (Dos uniones ∏).
Ejemplos:
Propino
CH ≡ C — CH3
Propiedades
físicas:
Los dos primeros son
gaseosos, del tercero al decimocuarto son líquidos y son sólidos desde el 15 en
adelante.
Su punto de ebullición
también aumenta con la cantidad de carbonos.
Los alquinos son
solubles en solventes orgánicos como el éter y alcohol. Son insolubles en agua,
salvo el etino que presenta un poco de solubilidad.
Propiedades
Químicas:
Combustión:
2 HC ≡ CH + 5
O2 ——> 4 CO2 + 2 H2O + 332,9 Kcal
Adición de Halógenos:
HC ≡ CH —-
CH3 + CL2 —> HCCl
= CCl — CH3
Propino
,2 – dicloro propeno
Nombrar
alquénos y alquínos
Los alquenos se nombran reemplazando
la terminación -ano del correspondiente alcano por -eno. Los alquenos más
simples son el eteno y el propeno.
Regla 1.- Se elige como cadena principal la de mayor longitud que
contenga el doble enlace. La numeración comienza en el extremo que otorga al
doble enlace el menor localizador.
Regla 2.- El nombre de
los sustituyentes precede al de la cadena principal y se acompaña de un
localizador que indica su posición en la molécula. La molécula se numera de
modo que el doble enlace tome el localizador más bajo.
Regla 3.- Cuando hay
varios sustituyentes se ordenan alfabéticamente y se acompañan de sus
respectivos localizadores
Regla 4.- Cuando el
doble enlace está a la misma distancia de ambos extremos, se numera para que
los sustituyentes tomen los menores localizadores.
Regla 5.- En compuestos
cíclicos resulta innecesario indicar la posición del doble enlace, puesto que
siempre se encuentra entre las posiciones 1 y 2.
Alquinos
Regla 1. Se elige como
cadena principal la de mayor longitud que contiene el triple enlace. La
numera-ción debe otorgar los menores localizadores al triple enlace.
Regla 2. Cuando la
molécula tiene más de un triple enlace, se toma como principal la cadena que
contie-ne el mayor número de enlaces triples y se numera desde el extremo más
cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino,
etc.
Regla 3. Si el
hidrocarburo contiene dobles y triples enlaces, se procede del modo
siguiente:
1. Se toma como cadena principal la que contiene al mayor número posible de
enlaces múltiples, prescindiendo de si son dobles o triples.
2. Se numera para que los enlaces en conjunto tomen los localizadores más
bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos
tiene preferencia el doble.
3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en
-eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un
doble la terminación es, -eno-diino.
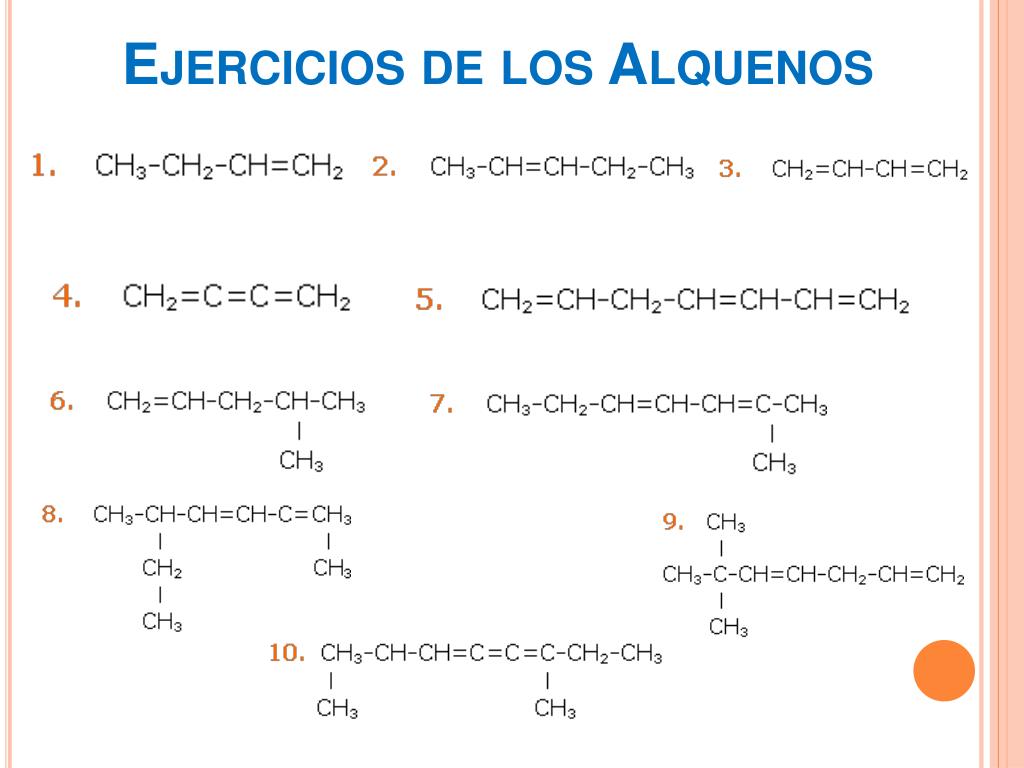
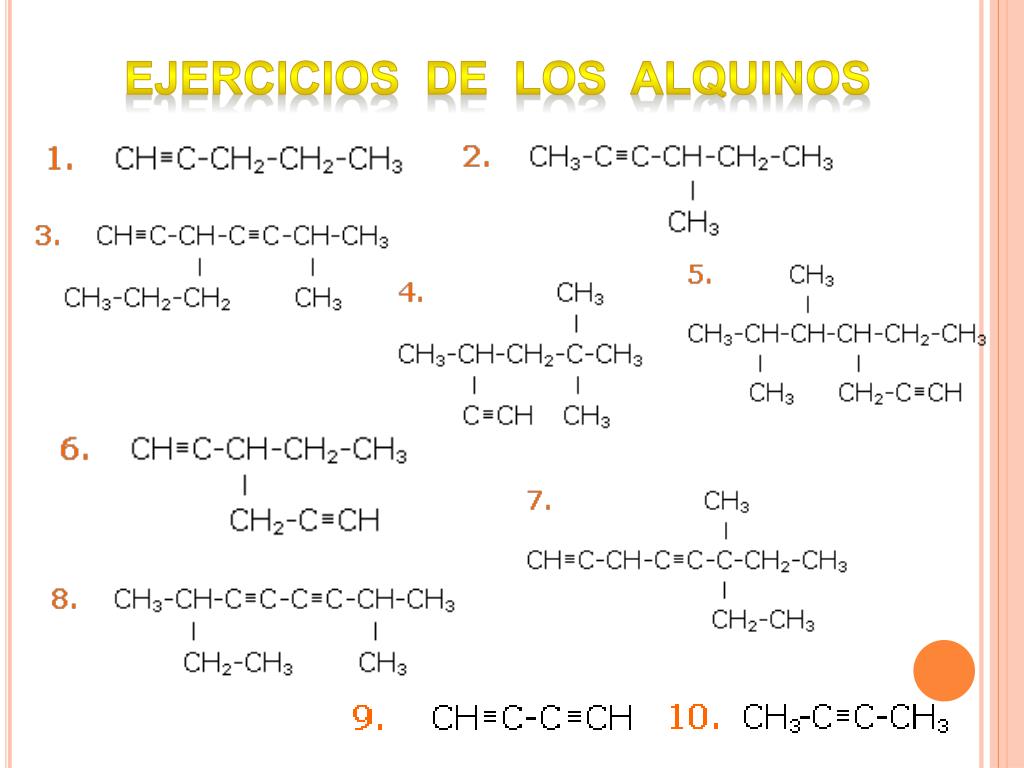
Falta información, varios de sus ejemplos son de alcanos no de alquenos ni alquinos
ResponderBorrar